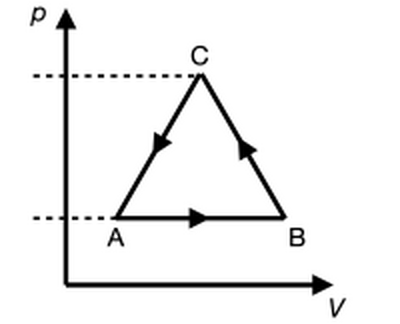
Si consideri una mole di gas perfetto monoatomico (R = 8.314 J/mol K, cV = 3R/2) che compie la trasformazione reversibile mostrata in
figura, che nel piano di Clapeyron forma un triangolo equilatero. Sappiamo che pA = 1 atm e VA = 10 litri, VB è il doppio di VA, e pC è tre
volte pA. Inoltre la trasformazione da A a B è una trasformazione isobara.
(a) Calcolare la variazione di energia interna del gas da A a B. RISP. ΔUAB = 1519.5 J
(b) Calcolare il lavoro compiuto dal gas e il calore scambiato nel ciclo. RISP. : Lciclo = -1013 J Qciclo = -1013 J