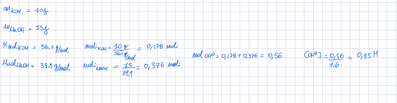$10 \mathrm{~g}$ di $\mathrm{KOH}$ e $15 \mathrm{~g}$ di $\mathrm{NaOH}$ vengono sciolti in acqua e la soluzione viene portata al volume di 1,6 L. Calcola la concentrazione molare degli ioni $\mathrm{OH}^{-}$ nella soluzione risultante.
$$
[C=0,346 \mathrm{~mol} / \mathrm{L}]
$$
buonasera se non disturbo mi aiutate nella risoluzione grazie