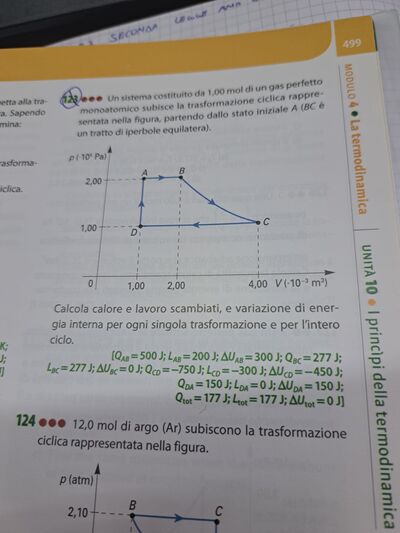
P * V = n R T; legge dei gas.
TA = PA * VA /( n R);
TA = 2,00 * 10^5 * 1,00 * 10^-3 /(1 * 8,314) = 24 K;
AB isobara; PA = PB; costante
TB / VB = TA / VA;
TB = TA * VB / VA = 24 * 2,00* 10^-3 / (1,00 * 10^-3) = 48 K;
QAB = Lavoro + DeltaU;
LAB = PA * (VB - VA) = 2,00 * 10^5 * (2,00 - 1,00) * 10^-3 = 200 J;
DeltaU AB = cv * n * (TB - TA) = 3/2 * 8,314 * 1 * (48 - 24);
DeltaU = variazione energia interna, è il calore che si immagazzina nel sistema e non fa lavoro, non fa variare il volume del gas.
cv = calore specifico a volume costante = 3/2 R = 12,271 J/molK.
Delta UAB = 12,471 * 24 = + 299 J = + 300 J circa;
QAB = 200 + 300 = 500 J, calore = assorbito in AB.
BC = isoterma; PC * VC = PB * VB; TC = TB;
Q = L; DeltaU BC = 0 J; perché T rimane costante.
L = n R TB * ln(VC / VB) = 1 * 8,314 * 48 * ln(4,00/2,00);
L BC = 8,314 * 48 * 0,693 = 277 J; lavoro isoterma BC ;
QBC = 277 J;
CD isobara;
L CD = PC * (VD - VC);
L CD = 1,00 * 10^5 * (1,00 - 4,00) * 10^-3 = - 300 J; lavoro negativo,
il gas viene compresso dall'esterno;
TD = PD * VD / nR = 1,00 * 10^5 * 1,00 * 10^-3 / 8,314 = 12 K;
DeltaU CD = cv * n * (TD - TC) = 12,471* 1 * (12 - 48) = - 449 J = - 450 J circa;
il gas cede calore, si raffredda;
Q ceduto DC = - 300 - 500 = - 800 J
DA = isocora; V = costante; Lavoro DA = 0 J;
QDA = DeltaU DA = cv * n * (TA - TD);
QDA = 12,471 * (24 - 12) = + 150 J; DA calore assorbito;
Q assorbito nel ciclo = QAB + QBC + QDA = 500 + 277 + 150 = 927 J;
Q ceduto = QDC = - 800 J;
L ciclo = 200 + 277 - 300 = 177 J, Lavoro utile;
Delta U ciclo = + 300 - 450 + 150 = 0 J.
L'energia interna in un ciclo non deve variare.
Ciao @edoardo_rastelli